- 人细胞凋亡抑制因子(IAP)ELISA试剂盒品牌:Xkbio...
- 手把手教你学会 CRISPR Cas9 基因敲除技术
- 11月6日|新风向即将亮相北京培训会展_企业
- 酶标仪与分光光度计的相同与不同
- BIOVIA上海迅筑汽车工程有限公司
- PM2.5 为 1,昨天北京还真有这样的地方!而且被我们找到...
- 【求助/交流】蛋白电泳缓冲液 分子生物 综合其他论坛...
- 免疫及分子诊断技术介绍_图文
- 临床研究中PK和BE有什么区别_问答详情_临床研究_其它试剂...
- 洁净车间培训讲解(22页)原创力文档
- 【sartomer沙多玛三羟甲基丙烷三甲基丙烯酸酯SR350...
- 洁净区“压差”的控制与压差规范要求大全
- [09-30]洁净一百家电清洗_洁净一百家电清洗加盟_洁净一百家电清洗加盟费...
- [04-23]300000级的洁净工作服可在非洁净室 100000级以上区域使用的洁净工...
- [02-10]GMP洁净区地漏清洁验证方案
- [09-30]洁净室人员行为与洁净室的清洁
- [09-30]洁净室消毒方法有哪些,怎么才能消毒彻底 www问答网
- [09-29]固体制剂车间洁净区使用的清洁布生产运营蒲公英 制药技术的...
- [03-01]微生物室洁净区清洁消毒记录
- [08-23]洁净服都验证什么?
- [11-08]【求助】洁净区专用工具清洁验证方案用擦拭法还是接触碟法? 新药...
洁净室及相关受控环境的专业解读
在
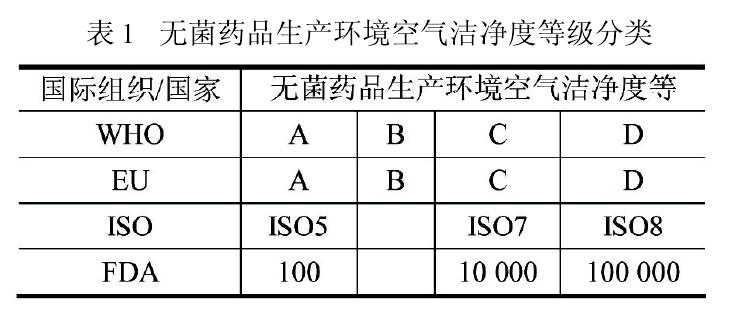
关于这两种看似不同的模式,欧盟GMP指南(2009)引言中有一段耐人寻味的表述:“本指南无意成为任何新概念或新技术发展的障碍,如果通过验证并证明所用方法能达到至少与本指南所述方法等价的质量保证水平,也应予以认同(TheGuideisnotintendedtoplaceanyrestraintuponthedevelopmentofanynewconceptsornewtechnologieswhichhavebeenvalidatedandwhichprovidealevelofQualityAssuranceatleastequivalenttothosesetoutinthisGuide)”。同时,它还明确表达“药品多年来按GMP要求生产,没有执行ISO的标准。企业可自行决定采用ISO标准作为实施制药领域质量体系的一种手段(ThemanufactureofmedicinalproductshasformanyyearstakenplaceinaccordancewithguidelinesforGMPandthemanufactureofmedicinalproductsisnotimplementbyISOstandards.Harmo-nizedstandardsasadoptedbytheISOmaybeusedatindustry’sdiscretionasatoolforimplementingaqualitysysteminthepharmaceuticalsector)”。
同样,FDA的指南文件也有类似内容的表述,足见这两种模式在国际制药行业的互认和共容。欧盟GMP指南与ISO14644.4在控制方法上的差异,并不说明它们在控制水平上的差距。国际制药企业在实施时可自行选用,无须厚此薄彼,只要认真执行都能达到同样的质量保证水平。因此,美国制药企业产品无需按欧盟的ABCD模式方可进入欧盟国家;同样欧盟制药企业产品也没有必要改成FDA的ACD模式才能进入美国市场。可是,当这两项国际标准演变成我国的法规和标准时,我国的制药企业就没有这么幸运。因为我国新版GMP在等效采用欧盟GMP指南时,删除了欧盟GMP指南的这段“提示”。新版GMP发布前,我国以往GMP中无菌药品生产环境的空气洁净度标准基本采用ACD模式。客观上,我国历版GMP内容和企业执行力度都与国际要求存在一定差距,追其原因错综复杂,我国无论在认知理念、综合国力、技术水平等方面都无法与国外发达国家相比,即使照搬照套国外GMP,也不能起到立竿见影的效果。如果新版GMP能根据国情吸纳欧盟GMP指南的宽容,大多数企业可在原有基础上进行填平补齐的改造,而无需如今伤筋动骨式的重建。这无论对国家还是对企业,都是值得深思的大事。
新版GMP是强制执行的国家行政法规,是制药企业认证检查的唯一标准,得不到认证证书,企业必须关停并转;而B/T25915是国家推荐标准,又无相应检查颁证手段,自然无法与新版GMP相提并论。出现如此问题,并不说明这两项标准的水平差距,而是国家行政制度、权力上的失衡,需要由政府有关部门采取措施予以弥合修补。GB/T25915.4(2010)-设计、建造、启动,即ISO14644.4的附录B,提出了无菌产品在颗粒物和微生物受控的洁净区内无菌灌装线上灌装的空气洁净度等级要求(表2)。
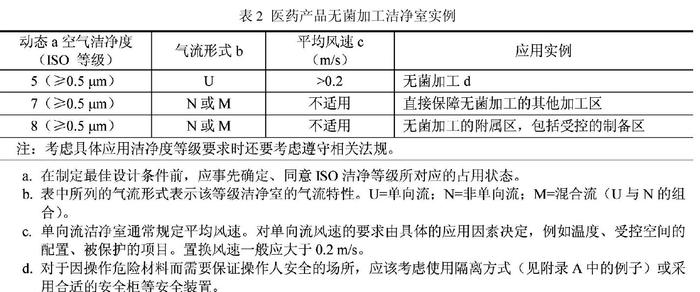
表2中值得我们注意的,一是空气洁净度等级的占有状态应在设计前由业主和设计人员事先商议确定。这是ISO14644系列标准在定义“动态”、“静态”时的一贯主张,因为各种占用状态都有它的使用价值,不能简单地以使用何种“占用状态”来评判标准的孰高孰低。受无菌药品灌装线上人员操作、设备性能、生产运行等因素影响,单向流罩下的空气洁净度往往难以测准,为确保测试状态的稳定性和判断结果的可比性,日本把测试要求原则上定为“静态”,也有国家规定动态检测范围不包括操作点或发尘点
GB/T25915.4(2010)有着与新版GMP同样的控制理念,都为了有效控制药品生产环境的污染。图1是GB/T25915.2010)的层式污染控制概念。工艺核心区(与环境发生交互作用的工艺位置)所在的区域为洁净区,是洁净室中受控最严的部分,空气洁净度等级为单向流100级(即ISO5级,欧盟A级)。出于经济、技术和运行等方面的原因,要尽量减小最高洁净度区域的范围。洁净区通常采用密闭式(如RABS),或由洁净度较低的外部区域-洁净室(1万级,即ISO7级)包围。相邻区域间的人流、物流进入工艺核心区时,会增加传播污染的风险,因此应特别注意人流和物流的布局细节与管理,这就是层式污染控制的基本概念。
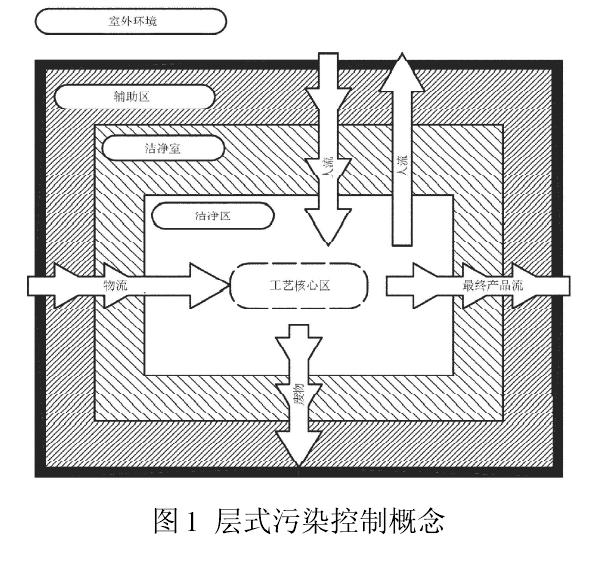
与GB/T25915.4(2010)不同的是新版GMP将包围洁净区的外部区域(洁净室)的空气洁净度等级设定为B级,所谓B级是静态控制时相同于A级(单向流100级)的静态,动态控制时相同于C级(1万级)的静态。GB/T25915.4(2010)和新版GMP都认为无菌灌装线外部区域(洁净室)空气洁净度等级应低于工艺核心区(洁净区),至于低多少,是1万级还是B级?这是可探讨的学术问题,不应成为判定标准高低的分界线。国内外实践证明,背景设置为1万级或B级,都能保护无菌药品的生产环境,我们应从分析影响无菌灌装线的环境因素着手,寻找控制污染源的途径,才能最终确保无菌生产环境。
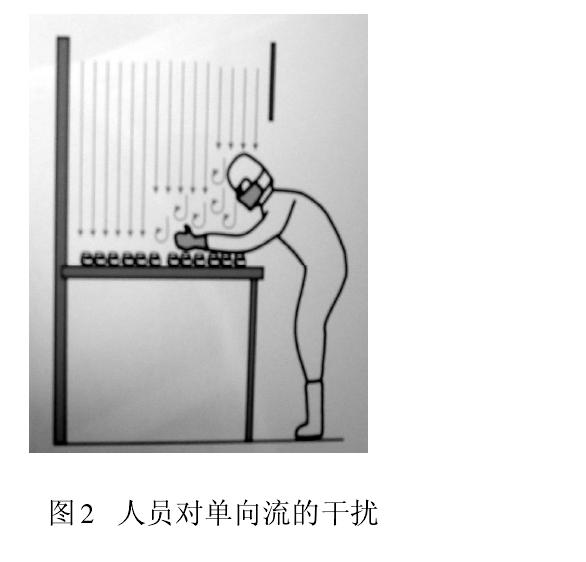
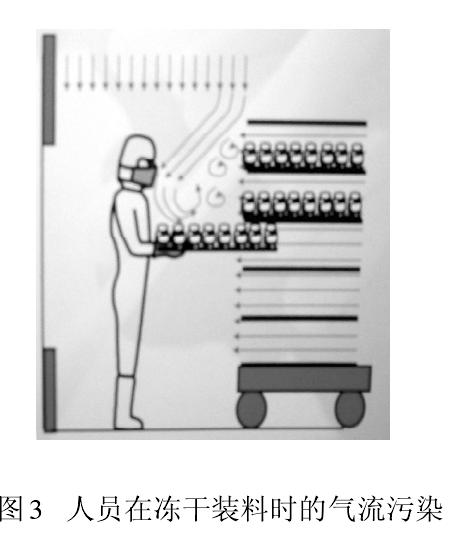
从人们开始接受并应用洁净技术时就发现,人是洁净室最大的污染源。以微粒和微生物为污染物控制对象的制药生产,大量测试数据和生产实践告诫我们,人员(生产、检验、管理、维修)因素无时无刻不在干扰药品生产。图2显示人员在单向流下操作导致气流粒子污染。此刻,保护性的单向流变成污染物的载体,直接影响被保护的产品。此时气流速度越大,则污染程度越大。图3为冻干剂装料时,单向流罩下垂直和水平气流相互冲突,
形成紊流,紊流气流会在较长时间里产生悬浮污染。
不言而喻,人是无菌灌装过程中影响最大的环境因素。为此,实现无菌灌装环境控制的技术要点是:(1)将人员从无菌环境隔离,从根本上排除人的干扰;(2)采取局部隔离无菌环境(如RABS等);(3)即便如此仍需限制人员对无菌产品的干预;(4)生产运行中不让人员进入无菌环境。不解决人对无菌环境干扰问题,大幅度提高无菌药品生产线外部区域空气洁净度等级,效果也不会明显。
必须强调,医药工程设计中空气净化措施只是控制洁净室微生物的手段之一,这些措施只能控制通过空气途径传播的微生物污染,对表面对象微生物的生物污染以及化学污染都无能为力,药品生产使用的设备、设施、容器具、物料、包装材料等沾附的微生物、化学品,以及生产、管理人员携带的微生物,只有采用清场、清洗、消毒、灭菌等措施,任何级别的净化空调都无法替代。
近年来国外对空气净化的滤菌效果提出质疑。数据表明1台
净技术老路,将会大大浪费洁净室建设费用和运行成本。
国标GB/T25915.4(2010)的内容包括规划和设计、建造和启动、检测和验收、文件等方面要求,涵盖工程建设的全过程,对我国医药行业尤为重要。药品生产实施GMP是一项系统工程,为药品生产提供符合GMP要求的厂房设施是企业实施GMP的先决条件。因此,医药工程项目必须按GMP要求实施规范管理,才能为企业实施GMP提供可靠保障。近年来国外针对医药工程项目的规范化管理,一项新的管理规范——GEP已在一些发达
国家悄然问世。GEP(医药工程质量管理规范)是GoodEngineeringPractice的缩写,是与GMP配套的药品生产管理文件。它的宗旨是“将已确立的工程设计方案和标准应用于项目的整个生命周期中,提供合适成本的解决方案”。我国至今尚无这方面的规范,工程项目大多由企业凭经验自行管理,主要依据是各类相关的国家标准,缺乏系统性、协调性。
国标GB/T25915.4(2010)的发布,为工程项目规划、设计、施工、试车、检测、验收等环节的规范化管理填补了空白,国标所附的大量资料性附录,如“设施的验收”、“设施的布局”、“建造和材料”、“洁净室的环境控制”、“待需方/用户与供方/设计方商定的补充技术要求”等,为项目的工程设计、采购供应、施工安装、试车验收、工程进度、技术质量、安全环保、资金运作、部门协调等提供了详尽的规范要求,制药企业应自觉以国标GB/T25915为准绳,并据此制订医药工程项目的GEP,确保工程项目符合GMP要求。
国标GB/T25915系列标准反映了当今国际“洁净室及相关受控环境”的新概念、新思路和新方法,是指导我国各行各业洁净技术的规范性文件,必将成为我国洁净技术蓬勃发展的新起点。
医药洁净室设计和管里应注意的要点
医药洁净工程净化空调设计参考
OLED洁净工程管理要点
洁净工程中坑、地道式人防工程消防安全措施
洁净室通风管道对火灾烟气扩散的影响
上一条:洁净室在国内的需求发展下一条:洁净车间中电气设备防潮方法
最新文章
- ·一种风淋室及无尘车间系统(下)
- ·一种风淋室及无尘车间系统(上)
- ·一种避免外部粉尘从预留通道处进入的无尘车间
- ·一种无尘车间员工更衣柜
- ·一种无尘车间专用的风幕装置
- ·一种无尘车间用回风窗
- ·一种不需要人工开启、方便带自动吹风功能的无尘车间
- ·一种适用于无尘车间中央空调净化装置
- ·一种带恒温水池的无尘车间
- ·一种高效无尘车间除尘系统
推荐文章
- ·地源热泵系统在天津市某办公楼中的应用
- ·中国洁净车间间接让液晶面板价格持续下跌
- ·洁净室净化空调系统保养维护注意事项
- ·一种无尘车间用回风窗
- ·电子信息系统机房设计规范(GB50174-2008)完整版
- ·2010版中国药典第二部(全文完整版)
- ·洁净室的规划应考虑哪些重点?
- ·洁净室所需的设备主要有哪些?
- ·溶液除湿空调系统在医院项目中的使用实例
- ·无尘室工程安全保证措施
================ 蚂蚁淘在线 ================
免责声明:本文仅代表作者个人观点,与本网无关。其创作性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不做任何保证或承诺,请读者仅作参考,并请自行核实相关内容
版权声明:未经蚂蚁淘在线授权不得转载、摘编或利用其他方式使用上述作品。已经经本网授权使用作品的,应该授权范围内使用,并注明“来源:蚂蚁淘在线”。违反上述声明者,本网将追究其相关法律责任。





